世界のバイオプロセスバリデーション市場規模(2024~2032年):試験種類別(抽出物/浸出物試験、微生物検査、完全性試験、ウイルスクリアランス試験、その他)、ステージ別、モード別、用途別、エンドユーザー別

市場概要
バイオプロセスバリデーションの市場規模
バイオプロセスバリデーションの世界市場規模は、2023年に約4億1650万米ドルと評価され、2024年から2032年にかけて年平均成長率10.7%で成長すると予測されています。バイオプロセスバリデーションは、バイオ医薬品産業における方法論的な計画であり、バイオ製品が品質に妥協することなく製造されることを重視しています。これは、原材料から始まり最終製品である最終製品に至るまで、バイオプロセスの様々な段階におけるすべての文書化された試験と分析を包含しています。このようなモニタリング技術は、安全で効果的な治療製品の製造を保証するために使用されます。
アウトソーシング生産のニーズの高まりは、複雑な品目の生産のアウトソーシングを刺激するため、この市場の主要な促進要因となっています。モノクローナル抗体、ワクチン、遺伝子治療を含むバイオ医薬品に対する需要の急増も大きな推進要因です。また、これらの製品には、品質、安全性、有効性の検証に重点を置いた広範なバリデーションとコンプライアンス要件が設定されており、バリデーションサービスの必要性を煽っています。世界保健機関(WHO)は、厳格なバリデーションが必要となるバイオ医薬品開発活動の活況を反映し、2021年だけでも320を超えるCOVID-19の有効なワクチン候補があると推定しています。
さらに、バイオ医薬品を適切に使用するためには、包括的なバリデーションによって安全性と品質が保証されなければなりません。このことは、詳細なバリデーションとモニタリングのプロセスを必要とするcGMPやその他の規制の緻密なバランスにも当てはまります。2020年には、FDAの生物製剤評価研究センター(CBER)が治療薬を56承認しており、バイオ医薬品分野で強固なバリデーションがさらに実践される必要があるという考えが強まっています。
バイオプロセスバリデーション市場の動向
バイオ医薬品企業が生産管理の改善や予算への配慮から製造受託機関(CMO)や開発・製造受託機関(CDMO)への依存を強めていることが、第三者によるバイオプロセスバリデーションサービスの需要を高めています。
契約の増加により、企業は社内のリソースを増やすことなくコアコンピタンスに集中することができます。NIHは、CMO/CDMOを利用するバイオ医薬品企業の増加を示しており、これは熟練した外部バリデーションに対する需要の増加につながります。
さらに、シングルユースシステム、連続バイオマニュファクチャリング、自動化は、新しいバリデーション戦略を必要とする新しいバイオプロセス技術の一例です。増加し多様化するバイオプロセス技術は、製品の品質と製造の生産性を向上させるために解決すべきバリデーション上の課題を提起します。
また、グローバルヘルスのサイロを集団的な取り組みに変えるため、FDAは2021年に臨床研究におけるデジタルツールによる遠隔データ収集に関する新しいガイドを発表し、バイオプロセスにおけるこれらのツールのバリデーションの必要性を強調しています。しかし、これらのバイオプロセス技術のバリデーションと検証のプロセスは、バイオ医薬品がより幅広い患者集団のために製造されるようになるにつれて、より重要になります。
バイオプロセスバリデーション市場の分析
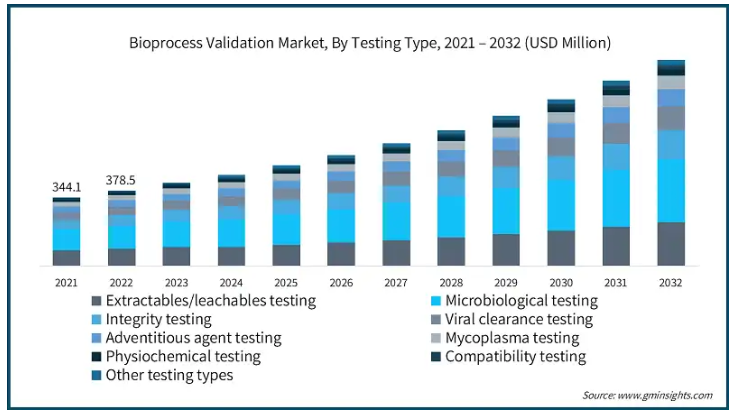
市場は、抽出物/浸出物試験、微生物学的試験、完全性試験、ウイルスクリアランス試験、不定病原体試験、マイコプラズマ試験、物理化学的試験、適合性試験、その他の試験の種類別に区分されます。2023年には、微生物検査分野が市場をリードし、1億2620万米ドルの収益を計上しました。
バイオ医薬品の急速な発展に伴い、FDA、EMA、WHOなどの機関は、より厳格なプロセスにつながる微生物検査の基準を引き上げています。FDAは「無菌製剤に関する業界向けガイダンス」の中で、適切なモニタリングを奨励しています。
また、医薬品の製造管理及び品質管理に関する基準(GMP)では、安全性と有効性を確保するために、バイオ生産のさまざまなレベルで微生物学的検査を実施しなければならないと定めています。このような継続的なプロセスは、患者の健康、安全性、製品の品質のために効果的な微生物学的検査を行う主なシナリオと必要性を示しています。
さらに、生物製剤、バイオシミラー、遺伝子治療の開発が加速していることから、徹底した微生物学的検査の重要性が高まっています。2016年から2021年にかけて、FDAによるバイオシミラーの承認率は30を超え、厳格な検査基準を重視する必要性が高まっています。
ほとんどの個別化医薬品の製造はバッチサイズが小さいため、交差汚染の防止を強化するため、より厳格な汚染管理が必要です。このような個別化治療へのシフトにより、製品の品質を維持するための微生物学的検査の強化がさらに必要となります。
迅速微生物検査法(RMM)、ポリメラーゼ連鎖反応(PCR)ベースの方法、自動化などの新しい微生物学的検査アプローチの開発により、汚染チェックのスピード、検出、効率が向上しました。これらの手順は、品質確認に必要な時間を大幅に短縮し、バイオ医薬品の迅速な患者への提供につながります。
したがって、これらの要因により、これらの標準処方の必要性は当面維持されるものと思われます。
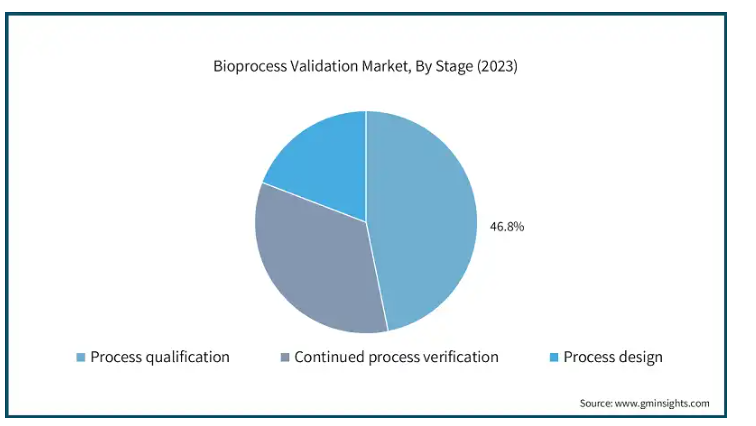
バイオプロセスバリデーション市場は、段階に基づき、プロセス設計、プロセス適格性確認、継続的プロセス検証に区分されます。2023年には、プロセス適格性確認分野が市場をリードし、46.8%の圧倒的な収益シェアを獲得。
プロセスの適格性確認(PQ)は、バイオプロセスのバリデーションに不可欠なステップです。PQの目的は、バイオ製造プロセスが一貫してバイオ製品の品質を達成することを実証することです。通常、プロセスの適格性確認はプロセス設計の後に行われ、バリデーションライフサイクル中の継続的なプロセス検証の前に行われます。これには、プロセスの頑健性と再現性を確認するために、現実的な操作シナリオを想定した条件下でプロセスを検証することが含まれます。
そのため、スケール、無菌性、コンタミネーションコントロールに関するこれらのシステムのバリデーションに対する資格サービスの必要性が高まっています。
したがって、こうした側面から、プロセス検証は今後数年間で大きく成長する見込みです。
バイオプロセスバリデーション市場は、形態によって社内とアウトソーシングに二分されます。インハウスセグメントは2032年までに7億200万米ドルに達すると予測されています。
インハウスバイオプロセスバリデーションとは、バイオテクノロジー・バイオ医薬品企業のプロセスのバリデーションが、外注ではなく自社施設で行われる状況を指します。この戦略により、製品の品質管理能力、規制への準拠、企業秘密の保護が向上します。
特に複雑な生物製剤の場合、作業工程がデリケートなため、また厳格な管理への準拠を確実にするため、社内でバリデーションを行うことを好む企業がいくつかあります。
さらに、継続的製造とQuality by Design(QbD)のコンセプトを採用するバイオ医薬品企業の増加により、継続的な社内バリデーションとプロセス管理の必要性が高まっています。これにより、プロセスを継続的に強化し、ばらつきを減らし、品質を管理することが可能になります。
したがって、これらの要因を考慮すると、内部セグメントは今後数年間で堅調な発展を遂げるでしょう。
バイオプロセスバリデーション市場は、用途別にバイオ医薬品、遺伝子・細胞治療、ワクチン、その他の用途に区分されます。2023年のバイオ医薬品分野の市場規模は2億1,590万米ドル。
バイオ医薬品製造のバリューチェーン全体は、従来の医薬品製造に比べてプロセスの感度が高まっているため、複雑さが増しています。原料や細胞培養、さらには周囲の環境の違いによって、最終製品の品質が劇的に変化する可能性があるからです。
そのため、バッチごとに製品の品質をモニターする必要性とともに、バイオプロセスのバリデーションが必要となります。このような現実は、生物製剤に対するニーズが非常に高まっているという事実とともに、バイオ医薬品製造におけるバイオプロセスバリデーションの重要性が、特に製品の品質、安全性、有効性に関して高まっていることを裏付けています。
さらに、慢性疾患や複雑な疾患の罹患率の増加により、モノクローナル抗体、ワクチン、遺伝子治療などの生物製剤の需要が増加しています。
バイオプロセスバリデーション市場は、エンドユーザー別に製薬企業、バイオテクノロジー企業、CROおよびCDMO、学術・研究機関に区分されます。2023年の製薬企業セグメントは1億8790万米ドル。
製薬業界では、生物製剤、細胞治療、遺伝子治療、バイオシミラーなどの新しい治療法が急速に進歩しています。これらの新技術は従来のシステムよりも複雑なため、製造工程でエラーが発生しやすい。
さらに、アメリカFDAが収集したデータによると、2020年現在、さまざまな開発段階にある細胞・遺伝子治療製品は400を超えます。これを考慮すると、一貫性を確保し、ばらつきを抑制するために、強固なバイオプロセスバリデーションを実施することが不可欠です。このような傾向は、製薬企業におけるバイオプロセスバリデーションの重要性を強調しています。
2023年、アメリカのバイオプロセスバリデーション市場規模は1億7,450万米ドルで、予測期間中の年平均成長率は10.8%と予測されています。
アメリカのFDAなどの規制当局は、バイオ医薬品の製造に関して厳しい措置を講じています。これらの規則では、安全性、有効性、品質の要件を満たすために、すべてのバイオプロセスを詳細に検証することが義務付けられています。企業が適正製造基準(GMP)規制を遵守するための検証要件は、全面的に義務付けられています。このような規制上の要請から、バリデーションという大きな枠組みの中で、新規のプロセスに費用を費やす必要があります。
さらに、需要は、発達した医療インフラと新しい治療法への支出によって十分に満たされています。これらの製品は複雑な性質を持っているため、それぞれの製品について入念なバイオプロセスバリデーションが必要です。
さらに、アメリカの個別化医療の拡大により、特定のバイオプロセスに対する需要が増加しているため、バリデーションにはより細部への注意が必要です。このように、前述の要因から、アメリカ市場の活動は今後数年間で成長すると予想されます。
2024年から2032年にかけて、英国のバイオプロセスバリデーション市場は顕著な拡大が見込まれます。
英国はバイオテクノロジーとバイオ医薬品の専門国として注目されており、生物製剤、細胞・遺伝子治療薬、先進治療薬(ATMP)の開発に携わる多くの企業を擁しています。このような広範なポートフォリオでは、特に臨床段階や商業段階に移行しつつある新しい治療法について、包括的なバイオプロセスのバリデーションが必要です。
企業は国内市場だけでなく輸出市場にもサービスを提供する必要があるため、バリデーション活動はさらに強化されるでしょう。これらの業務は、成長する業界の需要に応えるために新しい施設で実施する必要があり、そのためバリデーションが重要になります。
人々の情報化が進み、政府の支援も強化されているため、この地域の市場は今後数年で飛躍的に成長すると予想されます。
サウジアラビアのバイオプロセスバリデーション市場は、2024年から2032年にかけて大きく成長する見込みです。
サウジアラビアは2030年までに、バイオ医薬品の研究・開発・製造に多額の投資を行う計画を立てています。同国の医薬品製造業の自給自足を支持する政府のイニシアチブは、輸入品への依存を軽減します。この戦略は、国内の製造工場の成長を助けるだけでなく、バイオプロセスの検証や原薬などのバイオ医薬品に向けた投資の増加にもつながります。
したがって、これらの戦略の複合効果により、この地域の成長率は将来的に加速し、その結果、これらのバイオ医薬品にマーケティングの機会が生まれることになります。
主要企業・市場シェア
バイオプロセス検証市場のシェア
バイオプロセスバリデーション市場は、大企業や中堅企業、新規参入企業の存在により競争が激化しています。この分野で一歩先を行く重要な方法は、さまざまな技術を駆使して新製品を開発することであり、有力企業の大半はこれを活用しています。彼らが強い立場にあるのは、十分な資金を持ち、研究を重ねているからです。さらに、市場シェアを獲得し国際的に拡大するために、戦略的提携、買収、合併を行い、規制の変化に対応する最前線に立つことが重要かつ有利です。
バイオプロセスバリデーション市場参入企業
バイオプロセスバリデーション業界で事業を展開する著名な市場参加企業には、以下のような企業があります:
Asahi Kasei Corporation
Bio-Rad Laboratories
Charles River Laboratories
Danaher Corporation
Eurofins Scientific
Lonza Group
Meissner Filtration Products
Merck KGaA
Pace Analytical Services
Repligen Corporation
Sartorius AG
SGS S.A.
Thermo Fisher Scientific
Tosoh Corporation
WuXi AppTec
トッププレーヤーのUSP
ロンザグループは、バイオプロセスにおける規制遵守と製品の安全性のためのフルサービスのバリデーションソリューションを提供しています。
ザルトリウスAGは、バイオ医薬品製造のための効果的で検証されたシステムの提供に注力しています。
サーモフィッシャーサイエンティフィックは、バイオプロセスワークフローの精度とコンプライアンスに重点を置いたフルサービスのバリデーションを提供することができます。
バイオプロセスバリデーション市場の業界ニュース:
2024年7月、BioProcess360 Partnersは、従来のモノクローナル抗体(mAbs)および新薬モダリティのバイオプロセスのための新たなツールや技術の開発に携わる企業を支援することを目的とした投資ファンドの立ち上げを発表しました。このファンドは、投資資金、業界の専門家によるサポート、世界有数のバイオ医薬品企業とのコネクションを提供することで、研究開発(R&D)と商業化に関連する課題を克服する企業を支援することを目的としています。
2024年10月、サーモフィッシャーサイエンティフィックは、ハイデラバードのゲノムバレーにバイオプロセス設計センター(BDC)を設立する覚書をテランガナ州政府と締結しました。総面積10,000平方フィートのバイオプロセス・デザイン・センターは、2025年初頭に稼動する予定です。同センターは、インドおよびアジア太平洋地域における革新的なバイオ医薬品の開発・製造を加速するためのベンチマークとしての役割を果たすことを目的としています。同センターには、科学研究を促進するための最新鋭の研究所とトレーニング・ハブが設置される予定です。
この調査レポートは、バイオプロセスバリデーション市場を詳細に調査し、2021年~2032年の収益予測(百万米ドル)を掲載しています:
市場, 検査種類別
抽出物/浸出物試験
微生物試験
完全性試験
ウイルスクリアランス試験
不純物検査
マイコプラズマ検査
物理化学的試験
適合性試験
その他の検査種類別
市場, ステージ別
プロセス設計
プロセスの適格性確認
プロセス検証の継続
市場、モード別
インハウス
外部委託
アプリケーション別市場
バイオ医薬品
遺伝子・細胞治療
ワクチン
その他の用途
市場:エンドユーザー別
製薬会社
バイオテクノロジー企業
CROおよびCDMO
学術・研究機関
上記の情報は、以下の地域および国について提供されています:
北米
アメリカ
カナダ
ヨーロッパ
ドイツ
英国
フランス
スペイン
イタリア
オランダ
アジア太平洋
中国
日本
インド
オーストラリア
韓国
ラテンアメリカ
ブラジル
メキシコ
アルゼンチン
中東・アフリカ
南アフリカ
サウジアラビア
アラブ首長国連邦
【目次】
第1章 方法論と範囲
1.1 市場範囲と定義
1.2 調査デザイン
1.2.1 調査アプローチ
1.2.2 データ収集方法
1.3 ベース見積もりと計算
1.3.1 基準年の算出
1.3.2 市場推計の主要トレンド
1.4 予測モデル
1.5 一次調査と検証
1.5.1 一次情報源
1.5.2 データマイニングソース
第2章 エグゼクティブサマリー
2.1 産業3600の概要
第3章 業界インサイト
3.1 業界エコシステム分析
3.2 業界の影響力
3.2.1 成長ドライバー
3.2.1.1 安全性と品質に関する厳しい規制
3.2.1.2 バイオ医薬品需要の増加
3.2.1.3 ライフサイエンス分野における研究開発費の増加
3.2.1.4 バイオプロセスバリデーションアウトソーシング需要の増加
3.2.2 業界の落とし穴と課題
3.2.2.1 バリデーションの複雑さと時間集約性
3.2.2.2 バリデーションプロセスに関連する高コスト
3.3 成長可能性の分析
3.4 規制の状況
3.5 技術的展望
3.6 将来の市場動向
3.7 ギャップ分析
3.8 ポーター分析
3.9 PESTEL分析
第4章 競争環境(2023年
4.1 はじめに
4.2 企業シェア分析
4.3 企業マトリックス分析
4.4 主要市場プレーヤーの競合分析
4.5 競合のポジショニングマトリックス
4.6 戦略ダッシュボード
第5章 2021年~2032年の検査種類別市場推定・予測(単位:百万ドル)
5.1 主要動向
5.2 抽出物/浸出物検査
5.3 微生物検査
5.4 完全性試験
5.5 ウイルスクリアランス検査
5.6 付着菌検査
5.7 マイコプラズマ検査
5.8 物理化学的試験
5.9 適合性試験
5.10 その他の検査種類別
第6章 2021年~2032年のステージ別市場推定・予測($ Mn)
6.1 主要トレンド
6.2 プロセス設計
6.3 プロセス検証
6.4 プロセス検証の継続
第7章 市場の推定と予測:モード別、2021年~2032年 ($ Mn)
7.1 主要動向
7.2 インハウス
7.3 アウトソーシング
第8章 2021年~2032年 アプリケーション別市場予測・予測 ($ Mn)
8.1 主要動向
8.2 バイオ医薬品
8.3 遺伝子・細胞治療
8.4 ワクチン
8.5 その他の用途
第9章 2021〜2032年 エンドユーザー別市場予測・予測 ($ Mn)
9.1 主要動向
9.2 製薬企業
9.3 バイオテクノロジー企業
9.4 CROおよびCDMO
9.5 学術・研究機関
第10章 2021年~2032年 地域別市場予測・予測 ($ Mn)
10.1 主要動向
10.2 北米
10.2.1 アメリカ
10.2.2 カナダ
10.3 ヨーロッパ
10.3.1 ドイツ
10.3.2 イギリス
10.3.3 フランス
10.3.4 スペイン
10.3.5 イタリア
10.3.6 オランダ
10.4 アジア太平洋
10.4.1 中国
10.4.2 日本
10.4.3 インド
10.4.4 オーストラリア
10.4.5 韓国
10.5 ラテンアメリカ
10.5.1 ブラジル
10.5.2 メキシコ
10.5.3 アルゼンチン
10.6 中東・アフリカ
10.6.1 南アフリカ
10.6.2 サウジアラビア
10.6.3 アラブ首長国連邦
第11章 企業プロフィール
11.1 Asahi Kasei Corporation
11.2 Bio-Rad Laboratories
11.3 Charles River Laboratories
11.4 Danaher Corporation
11.5 Eurofins Scientific
11.6 Lonza Group
11.7 Meissner Filtration Products
11.8 Merck KGaA
11.9 Pace Analytical Services
11.10 Repligen Corporation
11.11 Sartorius AG
11.12 SGS S.A.
11.13 Thermo Fisher Scientific
11.14 Tosoh Corporation
11.15 WuXi AppTec
…
【本レポートのお問い合わせ先】
www.marketreport.jp/contact
レポートコード:GMI12192