結核&薬剤耐性結核検査の世界市場規模は2030年までにCAGR 5.7%で拡大する見通し

市場概要
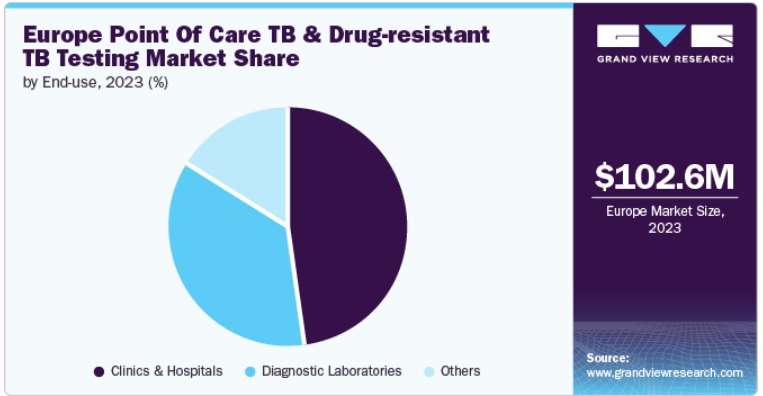
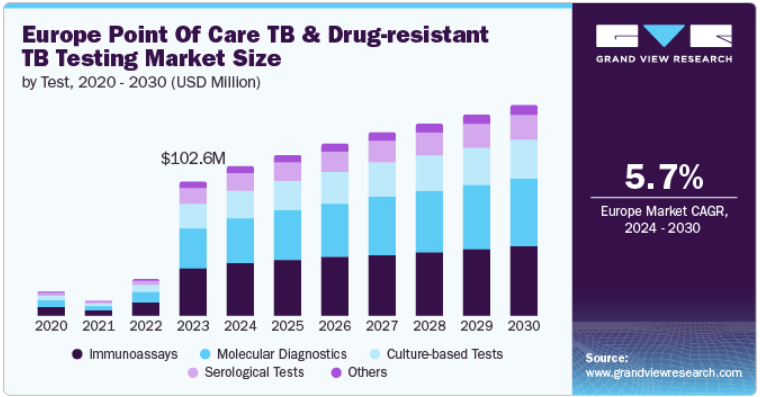
ヨーロッパの結核&薬剤耐性結核検査市場規模は、2023年に1億260万米ドルと推定され、2024年から2030年にかけて年平均成長率5.7%で成長する見込みです。欧州における結核とDR-TBの高い有病率は、政府や組織のイニシアチブの増加と相まって、この市場拡大の主な原動力となっています。欧州疾病予防管理センター(ECDC)によると、WHO欧州地域における結核の罹患率は2022年に上昇し、新たに報告された患者数は17万人を超え、2021年から増加しました。この増加傾向は、欧州における結核の持続的な課題を浮き彫りにし、高度な診断ソリューションの必要性を浮き彫りにしています。
結核は依然として欧州における公衆衛生上の重要な問題であり、特に多剤耐性結核(MDR-TB)や広範囲薬剤耐性結核(XDR-TB)といった薬剤耐性結核は、さらに重大な課題となっています。世界保健機関(WHO)は、世界の結核患者の約10%が薬剤耐性であると指摘しており、この病気を効果的に管理・封じ込めるためには、ヨーロッパにおける迅速かつ効果的な診断検査が不可欠であることを反映しています。欧州疾病予防管理センター(European Centre for Disease Prevention and Control)によると、薬剤感受性検査でリファンピシン耐性または多剤耐性(RR/MDR)を示した結核症例は4.9%でした。さらに詳しい検査を受けたMDR-TB症例のうち、26.9%が前XDR(pre-extensively drug-resistant)、10%がXDR(extensively drug-resistant)に分類されました。
HIVに関しては、ヨーロッパの21カ国が結核患者の73.6%をHIV感染者と報告し、そのうち4.1%がHIV陽性でした。治療成績もさまざまで、2021年に報告された全結核症例の成功率は64.0%、同年のHIV共同感染結核症例の成功率は54.0%、2020年からのRR/MDR-TB症例の成功率は52.5%、2020年に報告されたXDR-TB前症例の成功率は22.2%でした。これらの統計は、結核の管理、特に薬剤耐性やHIVとの共同感染という状況下での継続的な課題を強調するものです。
最近の技術的進歩は、結核&薬剤耐性結核検査検査市場を大きく牽引しています。GeneXpertやLAMP(Loop-mediated Isothermal Amplification)などの迅速分子診断検査などの技術革新により、結核診断のスピードと精度が大幅に向上しました。培養に基づく方法では従来数週間を要していたのに対し、これらの検査では数時間で結果が得られます。ヨーロッパにおけるこれらの迅速診断技術の採用は、迅速な治療開始と結核流行の効果的なコントロールに不可欠なリアルタイムの結果を提供する能力によって促進されています。
結核や薬剤耐性結核に対する社会の認識や教育活動の高まりが、高度な診断ツールに対する需要を後押ししています。公衆衛生キャンペーンでは、早期発見の重要性とポイントオブケア(PoC)検査の有効性が強調されています。欧州連合(EU)の抗菌薬耐性(AMR)対策行動計画と欧州結核サーベイランスネットワークは、結核対策の調整において極めて重要です。これらの戦略は、包括的な結核管理アプローチの一環として、タイムリーで正確な診断の必要性を強調しています。欧州結核サーベイランス・ネットワークは、欧州サーベイランス・システム(TESSy)およびWHOの結核モニタリング・評価データベースに電子的にデータを収集・報告し、その中には3年前までの治療成績に関するデータも含まれています。このネットワークの会合では、データの解釈を改善し、疾患サーベイランスと対応を強化するためにPoC検査を統合することを提唱することに重点を置いています。
ヨーロッパにおける結核&薬剤耐性結核検査市場は、現在進行中の技術的進歩や研究により、高度なイノベーションが行われていることが特徴です。次世代シーケンシング(NGS)や迅速PCRアッセイの統合など、最近の診断技術の発展は結核検査に革命をもたらしました。NGSは詳細な遺伝子情報を提供し、薬剤耐性株の検出を強化する一方、迅速PCRアッセイは迅速かつ正確な結果を提供し、タイムリーな結核管理に不可欠です。例えば、世界保健機関(WHO)が推奨するGeneXpert MTB/RIFアッセイは、数時間以内に結核とリファンピシン耐性を検出するのに役立っており、診断のスピードと精度が大幅に向上しています。
ヨーロッパの結核&薬剤耐性結核検査市場におけるM&Aは、技術的進歩と市場拡大の必要性により、競争環境を積極的に再構築しています。最近の注目すべき動きとしては、ダナハー社が結核検査を含む分子診断能力を強化するためにセファイド社を買収したことなどが挙げられます。2023年9月、ダナハーはセファイドのXpert MTB/RIF Ultra診断検査用カートリッジを、セファイドのグローバル・アクセス・プログラムの下、世界エイズ・結核・マラリア対策基金および対象国に1個7.97米ドルの割引価格で提供すると発表しました。このイニシアチブは、十分なサービスを受けていない地域における高品質の結核検査へのアクセスを強化するための幅広い取り組みの一環です。このような戦略的な協力関係は、診断の利用しやすさを改善し、公衆衛生の取り組みを推進するという市場のコミットメントを浮き彫りにするものです。
ヨーロッパの結核&薬剤耐性結核検査市場を形成する上で極めて重要な役割を果たしているのが規制であり、診断技術の開発と展開に影響を与えています。欧州医薬品庁(EMA)や各国の保健当局は、診断精度、安全性、有効性に関する厳しい基準を設けています。例えば、EUが2022年に導入した体外診断用医薬品(IVD)規制では、結核診断機器の厳格な臨床評価と性能試験が義務付けられています。これらの規制により、高品質で信頼性の高い検査だけが市場に出回ることになり、患者の健康を守り、診断結果を改善することができます。
ヨーロッパの結核&薬剤耐性結核検査市場の地域的拡大は、主に結核有病率の上昇と高度な診断ソリューションに対する需要の高まりによってもたらされます。重要な進展は、WHO欧州地域事務局が世界の結核プログラムおよびUSAIDと協力して、2024年5月にPASS to End TBイニシアチブを開始したことです。このイニシアチブは「東欧における結核撲滅のための地域プラットフォーム」の一部であり、2030年までに結核を撲滅するための取り組みを加速させることを目的としています。このイニシアチブは、COVID-19のパンデミックと現在進行中の人道危機によって強化された課題に対処するものです。このイニシアチブは、結核撲滅の目標達成に不可欠な結核サーベイランスと患者の転帰の改善に重点を置いています。このような取り組みにより、欧州のPoC結核・DR-TB検査市場は、診断能力の向上と的を絞った介入がますます不可欠となり、大きな成長と地域拡大が見込まれています。
市場は検査の種類により、分子診断、免疫測定、培養ベース、血清学的、その他に区分されます。2023年には、免疫測定法が34.9%の大幅なシェアで市場を席巻。免疫測定法には、迅速な結果や使いやすさなど、他の診断法にはない利点がいくつかあります。抗原抗体相互作用を利用して結核やDR-TBのバイオマーカーを検出するため、迅速な診断と治療に不可欠な結果が短時間で得られます。この迅速な結果は、結核を効果的に管理するための迅速な診断に対する緊急のニーズと一致しています。結核感染に関連する特定の抗体や抗原を検出する能力により、医療従事者は症例を迅速に特定することができ、これは特に欧州のような有病率の高い地域において有益です。
培養ベースの検査分野は、予測期間中にCAGR 5.7%で最速の成長が見込まれています。この成長の主な要因は、最近の技術の進歩と診断精度における大きな優位性です。BDのBACTEC MGIT 960システムや320システムのような培養ベースのシステムは、結核菌の検出や薬剤耐性の評価の効率を向上させています。これらの自動化システムは、スループットを向上させ、結果を得るために必要な時間を短縮し、結核管理における正確でタイムリーな診断の重要なニーズに対応します。これらの検査の感度と特異度が向上したことで、医療従事者は、正確な診断と効果的な治療計画に不可欠な、低レベルの細菌増殖も識別できるようになりました。さらに、薬剤耐性結核菌の管理が重視されるようになったことも、培養ベースの検査に対する需要を押し上げています。これらの検査は、特に増加傾向にあるMDR-TBやXDR-TBの症例において、耐性プロファイルを正確に判定し、適切な治療レジメンを導くために極めて重要です。
2023年には、診療所・病院セグメントが48.1%の最大売上シェアで市場を支配しました。診療所・病院は、包括的な診断・治療サービスを提供できることから、結核の診断・管理の主要な場となっています。診療所・病院は、分子診断や培養ベースの検査など、正確な結核・DR-TB検出のために不可欠な高度な診断ツールや技術を備えています。病院では、多剤耐性結核(MDR-TB)や広範囲薬剤耐性結核(XDR-TB)などの重篤で複雑な症例が扱われ、専門的な診断能力と治療プロトコルが必要とされます。
この成長の原動力となっているのは、耐性パターンを判定し、効果的な治療を導くための包括的な薬剤感受性試験を実施する上で重要な役割を担っていることです。正確な耐性プロファイリングに対する要求の高まりは、高度な診断技術への投資の増加につながります。次世代シークエンシング(NGS)や迅速PCRアッセイなどの技術革新により、結核およびDR-TB検出のスピードと精度が大幅に向上しています。これらの技術は、効果的な結核管理に不可欠なハイスループット検査とタイムリーな結果をサポートします。診断ラボは、高品質で標準化された検査の中心的な拠点となりつつあり、信頼性の高い結果を保証し、診断基準を維持することで、その拡大にさらに拍車をかけています。
英国の結核&薬剤耐性結核検査市場に拍車をかけている主な要因には、薬剤耐性症例の増加に加え、結核罹患率の増加があります。このため、効率的で迅速な診断ソリューションへの需要がさらに高まっています。英国健康安全保障局によると、イングランドでは2022年に4,300件を超える結核患者が新たに報告され、結核管理の持続的な課題を反映しています。国民保健サービス(NHS)とイングランド公衆衛生局は、結核の早期発見と管理を強化するため、先進的なポイントオブケア(PoC)技術に積極的に投資しています。NHS長期計画などのイニシアチブでは、結核の転帰を改善し、公衆衛生の取り組みを支援するために、迅速診断ツールの統合を強調しています。さらに、英国の移民規制では、高リスク国から英国に6カ月以上滞在する予定の個人に対して結核検査を義務付けており、利用しやすく実用的な結核検査の必要性がさらに強調されています。
ドイツの結核&薬剤耐性結核検査市場は、いくつかの推進要因によって活況を呈しています。ロバート・コッホ研究所によると、ドイツは欧州で結核の発生率が最も高い国の一つであり、2022年には約4,000人の新規患者が報告されます。結核と薬剤耐性株の両方に対応する迅速で正確な診断の必要性から、先進的なPoC技術の採用が増加しています。革新的な診断法を推進し、この分野の研究開発を支援するドイツ結核対策中央委員会は、ドイツ政府の結核対策へのコミットメントに反映されています。
スペインの結核&薬剤耐性結核検査市場は、いくつかの重要な要因によって大きな成長を遂げています。国立疫学サーベイランス・ネットワークのデータによると、スペインでは2021年に3,754件の結核患者が報告されるなど、結核の負担が大きくなっています。この高い罹患率により、迅速で正確な結果をもたらす高度な診断ソリューションに対する需要が高まっています。スペインの医療制度における最近の進歩は、最先端の分子診断法をルーチン検査プロトコールに組み込むなど、結核管理を著しく向上させています。スペインが引き続き診断技術の進歩を優先させる中、結核の流行が続く中、効率的で信頼性の高い診断ツールの必要性から、PoC結核・DR-TB検査市場は拡大が見込まれています。
主要企業・市場シェア
ヨーロッパの結核&薬剤耐性結核検査市場は、複数の主要企業が大きなシェアを占めているのが特徴です。これらの企業は幅広いポートフォリオを通じて業界をリードしています。
ヨーロッパの結核&薬剤耐性結核検査の主要企業
Cepheid (Danaher Corporation)
Molbio Diagnostics
Abbott Laboratories
BD (Becton, Dickinson and Company)
Roche Diagnostics
Qiagen
Lucira Health
BioMérieux
Thermo Fisher Scientific
Fujifilm (Fujifilm Healthcare)
MedMira
SD Biosensor
Trivitron Healthcare
2023年7月、EMPEダイアグノスティックスは、結核菌の存在と遺伝子型耐性に関する正確な情報を提供する、正確で迅速かつ安価な検査キット、mfloDx MDR-TB迅速検査キットを発売しました。CDSCOの承認を取得し、現在各国で臨床試験中。
2023年6月、シスメックス株式会社は欧州で抗菌薬感受性を迅速に検出するPOC検査(POCT)システムを発売しました。このシステムは、感染症を特定し、どの抗生物質が有効かを評価するもので、特に尿路感染症を対象としています。
2023年2月、QIAGEN N.V.は、結核のQuantiFERON-TB Gold Plus(QFT-Plus)検査がEUの新しい体外診断用医療機器規則(IVDR)2017/746に基づく認証を取得したと発表しました。QFT-Plus検査はWHOのお墨付きで、結核菌の確実な検出で知られています。この認証は、2022年後半にQIAGENがipsogen JAK2 RGQ PCRキットとNeuMoDxシステムズに対して先にIVDRのCEマークを取得したことに続くもので、高い診断基準と規制基準に対するQIAGENの献身を示すものです。
2022年12月、サーモフィッシャーサイエンティフィックはTrueMark Infectious Disease Research Panelsを発表しました。これらのパネルは、ウイルス、細菌、真菌、寄生虫感染を含む90以上の感染症をカバーしています。TrueMarkパネルは、研究者に正確で包括的なデータを提供し、伝染病研究や公衆衛生イニシアチブを支援することを目的としています。
2022年8月、BDとAccelerate Diagnostics, Inc.は、Accelerateの迅速検査ソリューションを共同開発する正式契約を締結しました。
本レポートでは、2018年から2030年までの国レベルでの収益成長を予測し、各サブセグメントにおける最新の業界動向の分析を提供しています。この調査についてGrand View Research社は、欧州のPOC(point of care)結核・薬剤耐性結核検査市場レポートを検査、エンドユース、国別に分類しています:
検査の展望(売上高、百万米ドル、2018年~2030年)
分子診断薬
免疫測定法
培養ベース検査
血清学的検査
その他
最終用途の展望(売上高、百万米ドル、2018年~2030年)
診療所および病院
診断研究所
その他
地域別展望(売上高、百万米ドル、2018年~2030年)
欧州
ドイツ
英国
フランス
イタリア
スペイン
デンマーク
スウェーデン
ノルウェー
ロシア
アルメニア
アゼルバイジャン
ベラルーシ
カザフスタン
その他のヨーロッパ
【目次】
第1章. 方法論とスコープ
1.1. 市場セグメンテーションとスコープ
1.2. セグメントの定義
1.2.1. テスト
1.2.2. 最終用途
1.2.3. 地域範囲
1.2.4. 推定と予測のタイムライン
1.3. 調査方法
1.4. 情報調達
1.4.1. 購入データベース
1.4.2. GVRの内部データベース
1.4.3. 二次情報源
1.4.4. 一次調査
1.4.5. 一次調査の詳細
1.4.5.1. 北米での一次インタビューデータ
1.4.5.2. 欧州での一次インタビューデータ
1.4.5.3. アジア太平洋地域の一次インタビューデータ
1.4.5.4. 中南米における一次インタビューデータ
1.4.5.5. MEAにおける一次インタビューデータ
1.5. 情報・データ分析
1.5.1. データ分析モデル
1.6. 市場形成と検証
1.7. モデルの詳細
1.7.1. 商品フロー分析(モデル1)
1.7.2. アプローチ1:商品フローアプローチ
1.8. 二次資料リスト
1.9. 一次資料リスト
1.10. 目的
第2章. 要旨
2.1. 市場の展望
2.2. セグメントの展望
2.2.1. テスト
2.2.2. 最終用途
2.2.3. 地域展望
2.3. 競合他社の洞察
第3章 欧州 欧州のPoC結核・薬剤耐性結核検査市場の変数、動向、スコープ
3.1. 市場系統の展望
3.1.1. 親市場の展望
3.1.2. 関連・付随市場の展望
3.2. 市場ダイナミクス
3.2.1. 市場ドライバー分析
3.2.1.1. 高い結核罹患率と薬剤耐性率
3.2.1.2. 政府と規制当局の支援
3.2.1.3. 技術の進歩
3.2.2. 市場阻害要因分析
3.2.2.1. 高度診断薬の高コスト
3.2.2.2. 規制とコンプライアンスの課題
3.3. 欧州のPoC結核および薬剤耐性結核検査市場の分析ツール
3.3.1. 産業分析 – ポーターの分析
3.3.1.1. サプライヤーの力
3.3.1.2. 買い手の力
3.3.1.3. 代替の脅威
3.3.1.4. 新規参入の脅威
3.3.1.5. 競争上のライバル
3.3.2. PESTEL分析
3.3.2.1. 政治情勢
3.3.2.2. 技術的ランドスケープ
3.3.2.3. 経済情勢
第4章. 欧州のPoC結核および薬剤耐性結核検査市場: 検査推計とトレンド分析
4.1. 欧州のPoC結核と薬剤耐性結核検査市場 検査ダッシュボード
4.2. 欧州のPoC結核および薬剤耐性結核検査市場:検査ダッシュボード 4.2: 検査動向分析
4.3. 欧州のPoC結核・薬剤耐性結核検査市場:検査別売上高
4.4. 分子診断薬
4.4.1. 分子診断薬市場の2018年から2030年までの推定と予測(百万米ドル)
4.5. 免疫測定法
4.5.1. 免疫測定法市場の2018年から2030年までの推定と予測(USD Million)
4.6. 培養ベースの検査
4.6.1. 培養ベース検査市場の2018~2030年の推定と予測(USD Million)
4.7. 血清学的検査
4.7.1. 血清学的検査市場の2018~2030年の推定と予測(USD Million)
4.8. その他
4.8.1. その他市場の2018~2030年の推定と予測(USD Million)
第5章 欧州 欧州のPoC結核および薬剤耐性結核検査市場 エンドユースの推定と動向分析
5.1. 欧州のPoC結核および薬剤耐性結核検査市場 エンドユーズダッシュボード
5.2. 欧州のPoC結核・薬剤耐性結核検査市場:エンドユーザー別動向分析 エンドユーザー動向分析
5.3. 欧州のPoC結核および薬剤耐性結核検査市場:エンドユース別推計と予測、収益(百万米ドル)
5.4. 診療所および病院
5.4.1. 診療所と病院市場の2018〜2030年までの推定と予測(USD Million)
5.5. 診断研究所
5.5.1. 診断ラボ市場の2018年から2030年までの推定と予測(USD Million)
5.6. その他
5.6.1. その他市場の2018~2030年の推定と予測(USD Million)
…
【本レポートのお問い合わせ先】
www.marketreport.jp/contact
レポートコード:GVR-4-68040-453-8