世界の医療関連肺炎市場規模:2023年に6億6,610万ドルを占め、2034年には9億8,390万ドルに達すると推定

市場規模
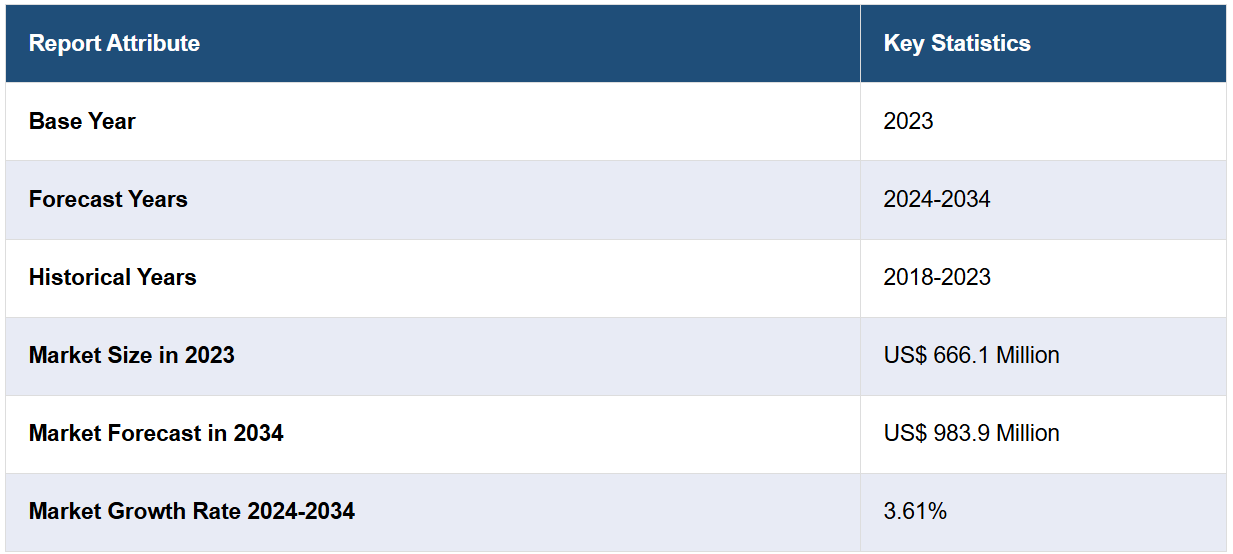
7つの主要な医療関連肺炎市場は、2023年には6億6,610万米ドルに達する見込みです。IMARC Groupは、7MMが2034年までに9億8,390万米ドル に達すると予測しており、2024年から2034年の間の成長率(CAGR)は3.61%となる見通しです。
医療関連肺炎市場は、IMARCの最新レポート「医療関連肺炎市場:疫学、業界動向、シェア、規模、成長、機会、予測 2024年~2034年」で包括的に分析されている。医療関連肺炎(HCAP)とは、医療環境との接触が原因で発生する肺炎の一種である。この肺炎は、過去に入院歴がある、在宅輸液療法、透析、介護施設での居住、免疫低下状態など、いくつかのリスク要因の存在と関連しています。細菌感染は、ウイルスとは対照的に、このタイプの肺炎の主な原因です。医療関連肺炎のほとんどの症状は、病院外で発症した肺炎の症状と同等です。この症状は、不快感、不安感、食欲減退、緑色または粘液状の痰を伴う咳、腹部の不快感、呼吸困難を特徴とします。その他の症状としては、呼吸や咳によって悪化する鋭い胸痛、血圧の低下や心拍数の増加などがあります。医療関連肺炎の診断は、胸部X線検査またはCTスキャンによる肺の検査、動脈血ガス分析による呼吸数の測定から始まります。 また、肺炎の原因となる微生物を検出するための喀痰培養検査や、血中酸素濃度を測定するパルスオキシメトリー検査も行われます。 誤った予後診断を避けるために不可欠な気管支鏡検査も診断に含まれます。
心停止、脳卒中、腎不全など、外科的介入や長期入院を必要とする慢性疾患の増加が、世界的な医療関連肺炎市場の主な推進要因となっています。さらに、抗生物質の過剰使用により抗菌耐性を持つ医療施設入院患者数の増加も、市場成長に好影響を与えています。さらに、細菌が耐性を獲得する可能性を低減し、広範囲をカバーする効果があるため、HCAPの治療に併用療法がますます利用されるようになっていることも、市場に明るい見通しをもたらしています。これに加え、利便性、迅速な診断、患者の予後の改善など、関連する利点により、ポイント・オブ・ケア検査製品が広く採用されていることも、大きな成長要因となっています。さらに、耐性菌の継続的な発生と、それによる新しい抗生物質へのニーズの高まりが、広範な研究開発活動を促進しています。これにより、世界市場も拡大しています。また、医療関連肺炎の診断における多重PCRベースのプラットフォームの人気が高まっていることも、市場成長を後押ししています。このプラットフォームは、高い検出効率によりコストと時間を削減できるためです。さらに、主要企業が高度な臨床ソリューションを活用して効率的なワクチンや抗生物質の開発に重点的に取り組んでいることも、今後数年間で世界的な医療関連肺炎市場を牽引すると予想されています。
IMARC Groupの最新レポートは、米国、EU5(ドイツ、スペイン、イタリア、フランス、英国)、日本における医療関連肺炎市場の徹底的な分析を提供しています。これには、治療方法、市場、開発中の薬剤、個々の治療法のシェア、7つの主要市場における市場実績、主要企業およびその薬剤の市場実績などが含まれます。また、本レポートでは、7つの主要市場における現在の患者数と将来の患者数も予測しています。本レポートによると、医療関連肺炎の患者数が最も多いのは米国であり、その治療市場も最大となっています。さらに、現在の治療方法/アルゴリズム、市場の推進要因、課題、機会、償還シナリオ、未充足の医療ニーズなども報告書に記載されています。この報告書は、医療関連肺炎市場に何らかの利害関係を有する、または何らかの形で市場に参入しようと計画しているメーカー、投資家、事業戦略家、研究者、コンサルタントなどすべての方にとって必読の報告書です。
調査期間
基準年:2023年
歴史的期間:2018年~2023年
市場予測:2024年~2034年
対象国
米国
ドイツ
フランス
英国
イタリア
スペイン
日本
各国の分析内容
過去の、現在の、および将来の疫学シナリオ
過去の、現在の、および将来の医療関連肺炎市場の実績
市場における各種治療カテゴリーの過去の、現在の、および将来の実績
医療関連肺炎市場における各種薬剤の売上
市場における償還シナリオ
市場および開発中の薬剤
競合状況
このレポートでは、現在の医療関連肺炎の市販薬および後期開発段階にある薬剤の詳しい分析も提供しています。
市場にある薬剤
薬剤概要
作用機序
規制状況
臨床試験結果
薬剤の普及状況と市場実績
後期開発段階にあるパイプライン薬剤
薬剤概要
作用機序
規制状況
臨床試験結果
薬剤の普及状況と市場実績
【目次】
1 はじめに
2 範囲と方法論
2.1 本調査の目的
2.2 利害関係者
2.3 データソース
2.3.1 一次ソース
2.3.2 二次ソース
2.4 市場予測
2.4.1 ボトムアップアプローチ
2.4.2 トップダウンアプローチ
2.5 予測方法論
3 エグゼクティブサマリー
4 医療関連肺炎 – はじめに
4.1 概要
4.2 疫学(2018年~2023年)および予測(2024年~2034年)
4.3 市場概要(2018年~2023年)および予測(2024年~2034年)
4.4 競合情報
5 医療関連肺炎 – 疾患概要
5.1 はじめに
5.2 症状と診断
5.3 病態生理学
5.4 原因とリスク要因
5.5 治療
6 患者の経過
7 医療関連肺炎 – 疫学と患者数
7.1 疫学 – 主な洞察
7.2 疫学シナリオ – トップ7市場
7.2.1 疫学シナリオ(2018年~2023年
7.2.2 疫学予測(2024年~2034年)
7.3 疫学シナリオ – 米国
7.3.1 疫学シナリオ(2018年~2023年)
7.3.2 疫学予測(2024年~2034年)
7.4 疫学シナリオ – ドイツ
7.4.1 疫学シナリオ(2018年~2023年)
7.4.2 疫学予測(2024年~2034年)
7.5 疫学シナリオ – フランス
7.5.1 疫学シナリオ(2018年~2023年)
7.5.2 疫学予測(2024年~2034年)
7.6 疫学シナリオ – 英国
7.6.1 疫学シナリオ(2018年~2023年)
7.6.2 疫学予測(2024年~2034年)
7.7 疫学シナリオ – イタリア
7.7.1 疫学シナリオ(2018年~2023年)
7.7.2 疫学予測(2024年~2034年)
7.8 疫学シナリオ – スペイン
7.8.1 疫学シナリオ(2018年~2023年)
7.8.2 疫学予測(2024年~2034年)
7.9 疫学シナリオ – 日本
7.9.1 疫学シナリオ(2018年~2023年)
7.9.2 疫学予測(2024年~2034年)
8 医療関連肺炎 – 治療アルゴリズム、ガイドライン、および医療行為
8.1 ガイドライン、管理、および治療
8.2 治療アルゴリズム
9 医療関連肺炎 – 未充足ニーズ
10 医療関連肺炎 – 治療の主要評価項目
11 医療関連肺炎 – 販売製品
11.1 トップ7市場における医療関連肺炎治療薬の一覧
11.1.1 メロペネム – メリンタ・セラピューティクス
11.1.1.1 薬剤の概要
11.1.1.2 作用機序
11.1.1.3 規制当局による審査状況
11.1.1.4 臨床試験結果
11.1.1.5 主要市場における売上
11.1.2 アビバクタム – アラガン
11.1.2.1 薬剤概要
11.1.2.2 作用機序
11.1.2.3 規制当局による審査状況
11.1.2.4 臨床試験結果
11.1.2.5 主要市場における売上
11.1.3 セフトビプロールメドカリル – バシレア・ファーマシューティカ
11.1.3.1 医薬品概要
11.1.3.2 作用機序
11.1.3.3 規制状況
11.1.3.4 臨床試験結果
11.1.3.5 主要市場における売上
11.1.4 ゼルバックス – Merck Sharp & Dohme
11.1.4.1 薬剤概要
11.1.4.2 作用機序
11.1.4.3 規制当局の対応
11.1.4.4 臨床試験結果
11.1.4.5 主要市場での売上
11.1.5 フェトロジャ – 塩野義製薬株式会社
11.1.5.1 薬剤概要
11.1.5.2 作用機序
11.1.5.3 規制状況
11.1.5.4 臨床試験結果
11.1.5.5 主要市場での売上
上記のリストは上市薬の一部のリストであり、完全なリストはレポートに記載されていることにご留意ください。
12 医療関連肺炎 – 開発中の薬剤
12.1 トップ7市場における医療関連肺炎治療薬パイプラインの一覧
12.1.1 Suvratoxumab – 塩野義製薬株式会社
12.1.1.1 薬剤概要
12.1.1.2 作用機序
12.1.1.3 臨床試験結果
12.1.1.4 安全性および有効性
12.1.1.5 規制状況
12.1.2 セフトロザン – Merck & Co
12.1.2.1 薬剤概要
12.1.2.2 作用機序
12.1.2.3 臨床試験結果
12.1.2.4 安全性および有効性
12.1.2.5 規制状況
12.1.3 リファブチン – BioVersys
12.1.3.1 薬剤概要
12.1.3.2 作用機序
12.1.3.3 臨床試験結果
12.1.3.4 安全性および有効性
12.1.3.5 規制当局による審査状況
12.1.4 トサトキシマブ – Aridis Pharmaceuticals
12.1.4.1 薬剤概要
12.1.4.2 作用機序
12.1.4.3 臨床試験結果
12.1.4.4 安全性と有効性
12.1.4.5 規制状況
…
【お問い合わせ・ご購入サイト】
資料コード:SR112025A6681
